Migreenin voi nähdä keskushermostorefleksinä, joka pyrkii palauttamaan hermoston tasapainotilanteen (homeostaasi). Ennen kohtausta autonominen hermosto on epätasapainossa ja parasympaattinen (mm. verisuonia laajentava) osa dominoi sympaattiseen verrattuna. Tasapainotilanteen sensori, hypotalamus, aistii tilanteen ja käynnistää kohtauksen. Migreenissä tämä reaktio on kuitenkin ylimitoitettu ja laukeaa liian herkästi. Otollinen tilanne kohtaukselle voi syntyä sekä parasympaattisen hermoston aktivoituessa (stressin laukeaminen) että sympaattisen hermoston väsähtäessä (pitkäaikainen stressi).1,2
Migreenin patofysiologia
Migreenin syntymekanismit
Video 1. Hypotalamus.
Hypotalamus on kehon sisäisen ja ulkoisen tasapainon sensori. Se käynnistää kohtauksen (prodromaalioireet) ja trigeminovaskulaarijärjestelmän (päänsärky). Hypotalamuksella on laajat yhteydet keskushermostossa, mukaan lukien yhteys pään alueen tärkeimpään kipuhermoon, nervus trigeminukseen. Trigeminuksen verisuonia hermottava osa (trigeminovaskulaarijärjestelmä) on migreenipäänsäryn alkulähde. Aivokalvoilta kipurata jatkuu hermoa pitkin aivorunkoon ja sieltä edelleen talamukseen ja aivokuorelle. Kivun monistumista radan alkuosassa kutsutaan perifeeriseksi sensitaatioksi ja samaa ilmiötä aivorunko-talamus-akselilla sentraaliseksi sensitaatioksi. Migreenipäänsäryn kova intensiteetti johtuu perifeerisestä, taipumus kroonistumiseen sentraalisesta sensitaatiosta. 1,2
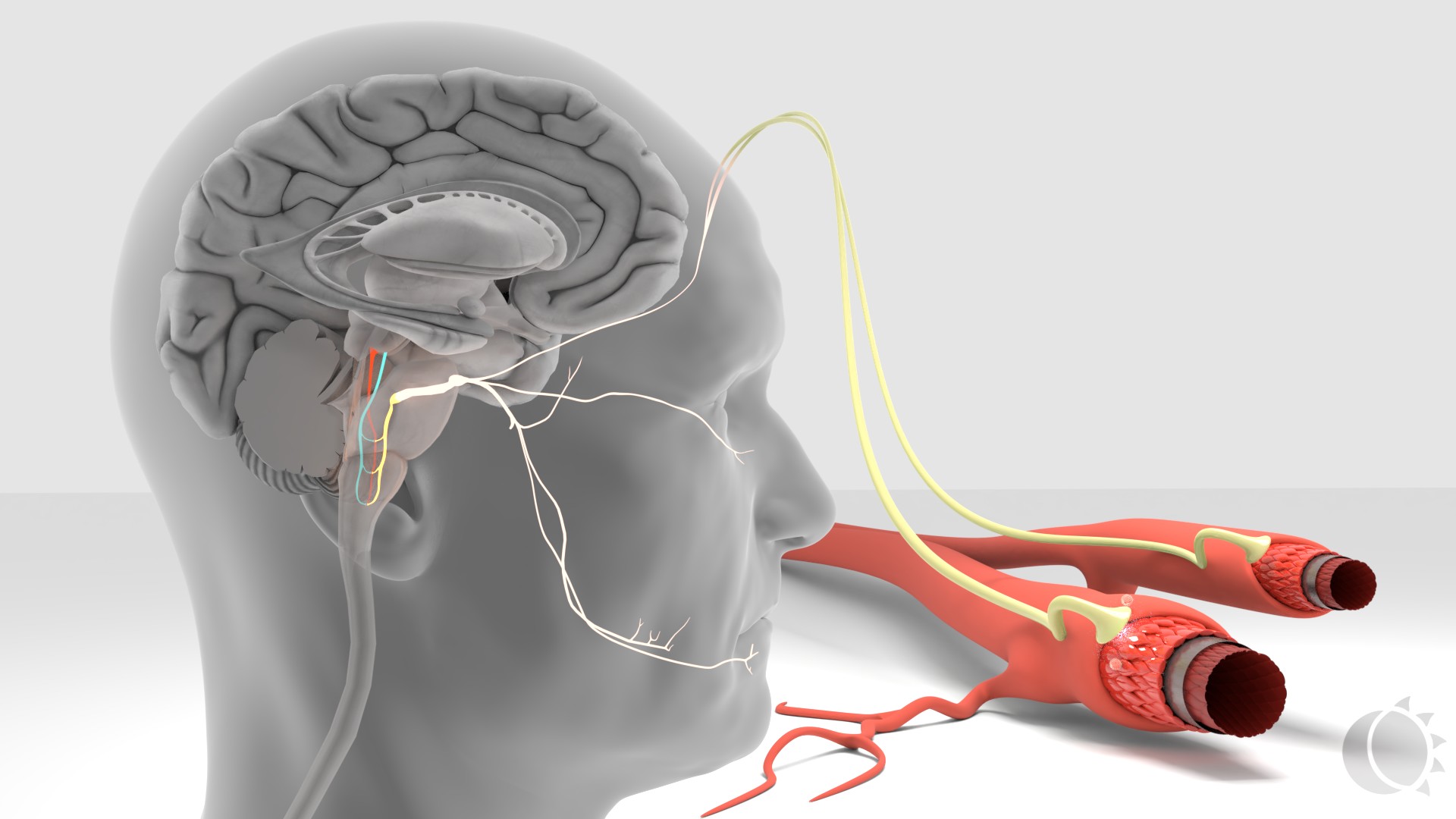
Kuva 1. Trigeminovaskulaarijärjestelmä.
Pään alueen muut kipuherkät kudokset, aivokalvojen lisäksi, voivat olla mukana kohtauksen synnyssä. Aistimukset yhdistyvät, sekoittuvat ja summautuvat aivorungossa ja seurauksena on kova, vaikeasti paikannettava päänsärky, johon liittyy myös tuntemuksia niskassa, kasvoissa tai leukanivelen alueella. 1,2
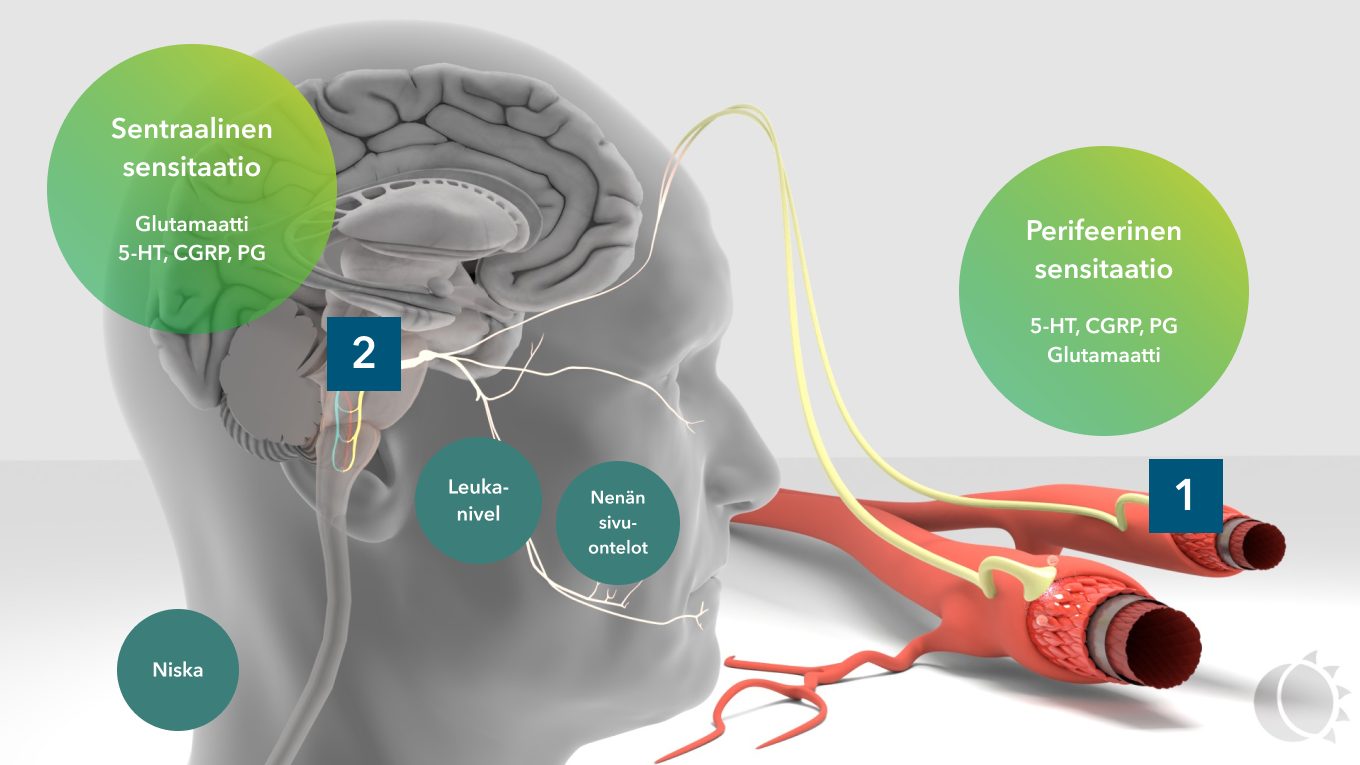
Kuva 2. Trigeminovaskulaarisen järjestelmän sensitaatiot.
Parasympaattinen hermosto on mukana lisäämässä päänsäryn intensiteettiä. Sen säikeet saavat alkunsa aivorungosta (ylempi syljeneritystumake, nucleus salivatorius superior) ja kulkevat ganglion pterygopalatinumin (siipilisäke-suulakihermosolmu) kautta kyynelrauhasiin ja nenään. Tämän radan aktivaatio aiheuttaa kohtauksen aikaisen kyynelvuodon ja nenän tukkoisuuden. Sarjoittaisessa päänsäryssä sama ilmiö on erityisen voimakas (Hortonin päänsärky eli cluster-päänsärky). 1,2
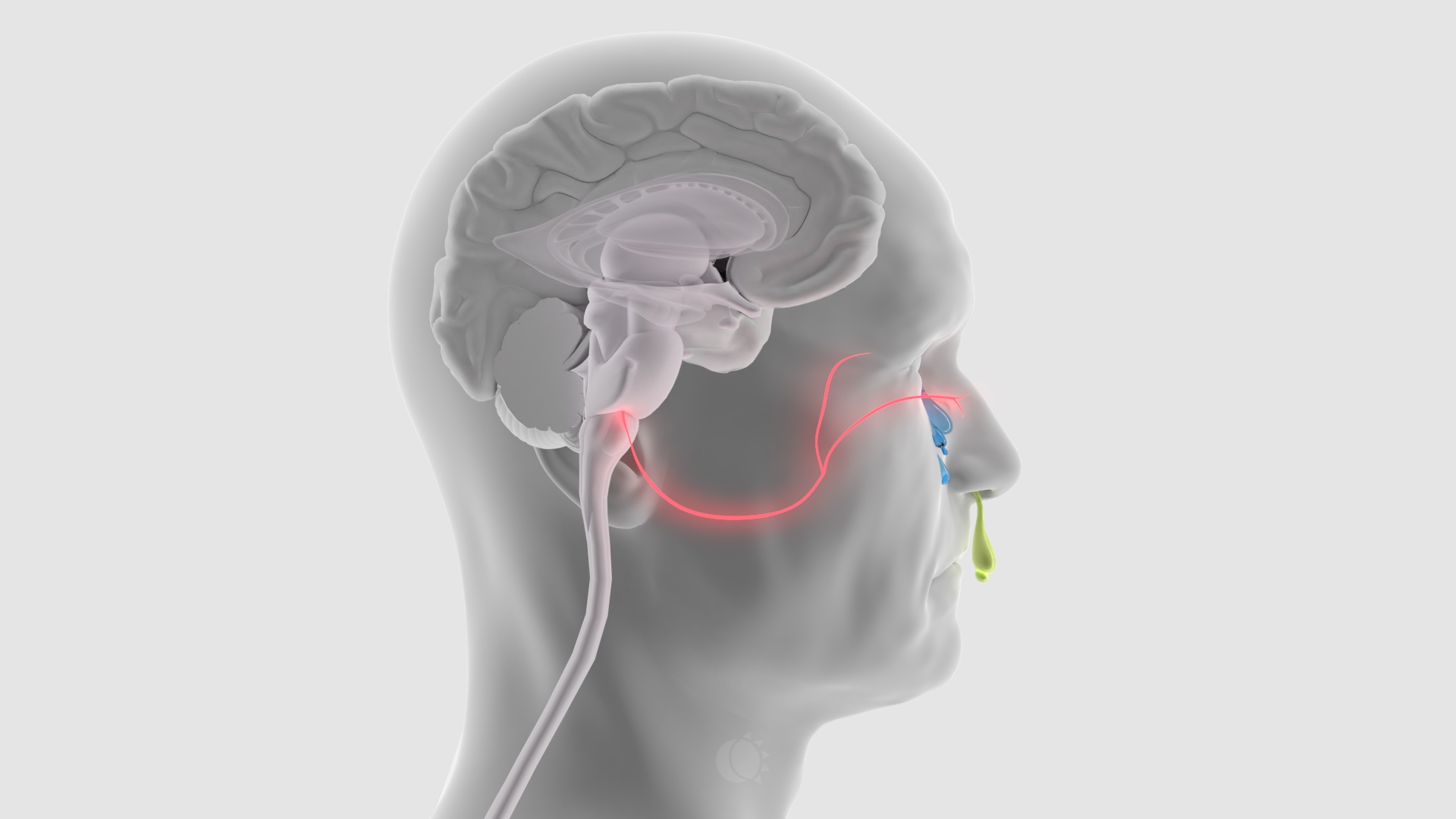
Kuva 3. Trigminoautonominen heijaste.
Kohtauksen edetessä syntyy noidankehä, jota ylläpitävät parasympaattinen hermosto, aivorunko ja trigeminovaskulaarijärjestelmä. Tilanne ei ole ylempien aivokeskusten valvonnassa. Tästä seuraa se, että päänsärky jatkuu hallitsemattomana ja kohtaus pitkittyy. 1,2
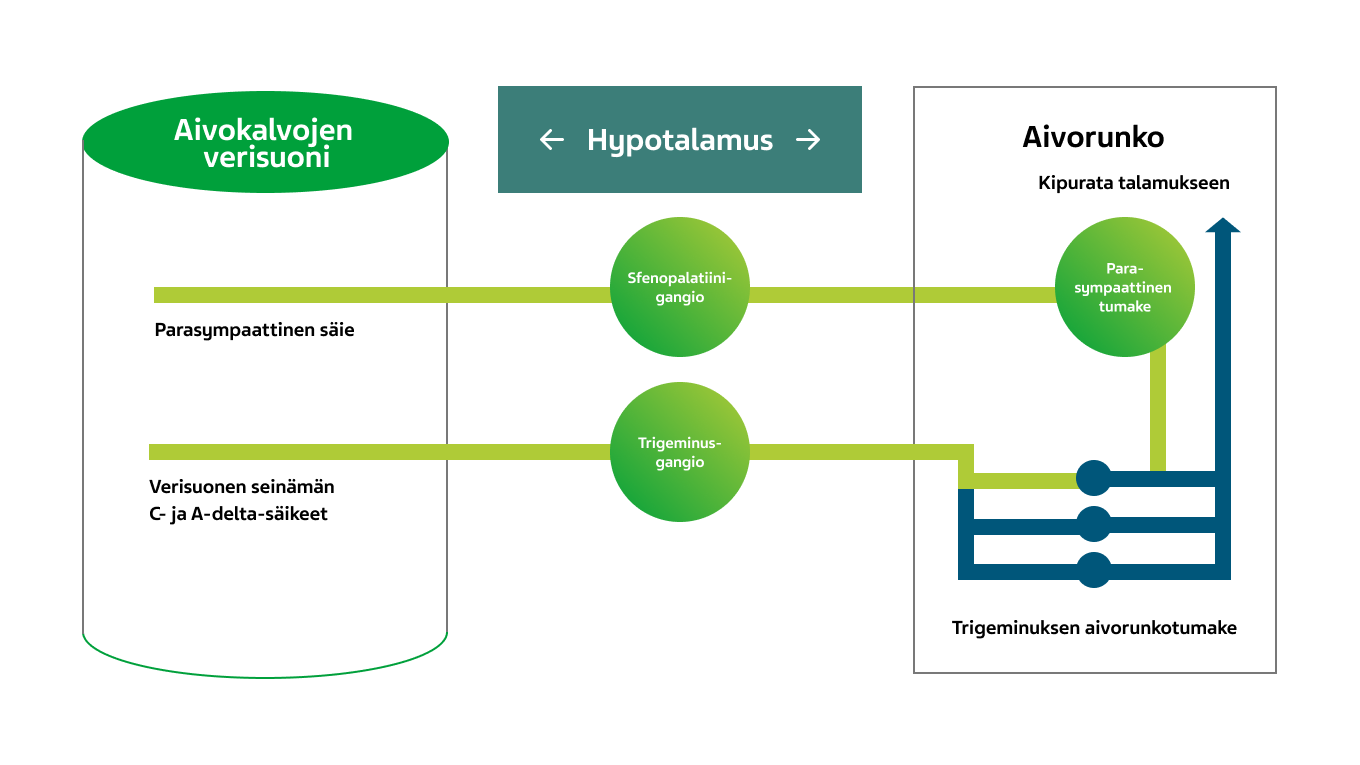
Kuva 4. Trigeminoautonomista kipua ylläpitävä refleksi.1
Arkuus valolle ja äänille on migreenipäänsäryn tyypillinen lisäoire. Normaalitilanteessa aivorungossa vallitsee tasapainotilanne – aistimuksia (kipu, ääni, valo, hajut, liike) hillitsevät ja niitä voimistavat radat kumoavat toisensa. Migreenikohtauksen aikana inhibitio pettää ja kaikki ärsykkeet, kipu mukaan lukien, pääsevät aivokuorelle ja aiheuttavat päänsärkyyn liittyvät muut oireet. 1,2
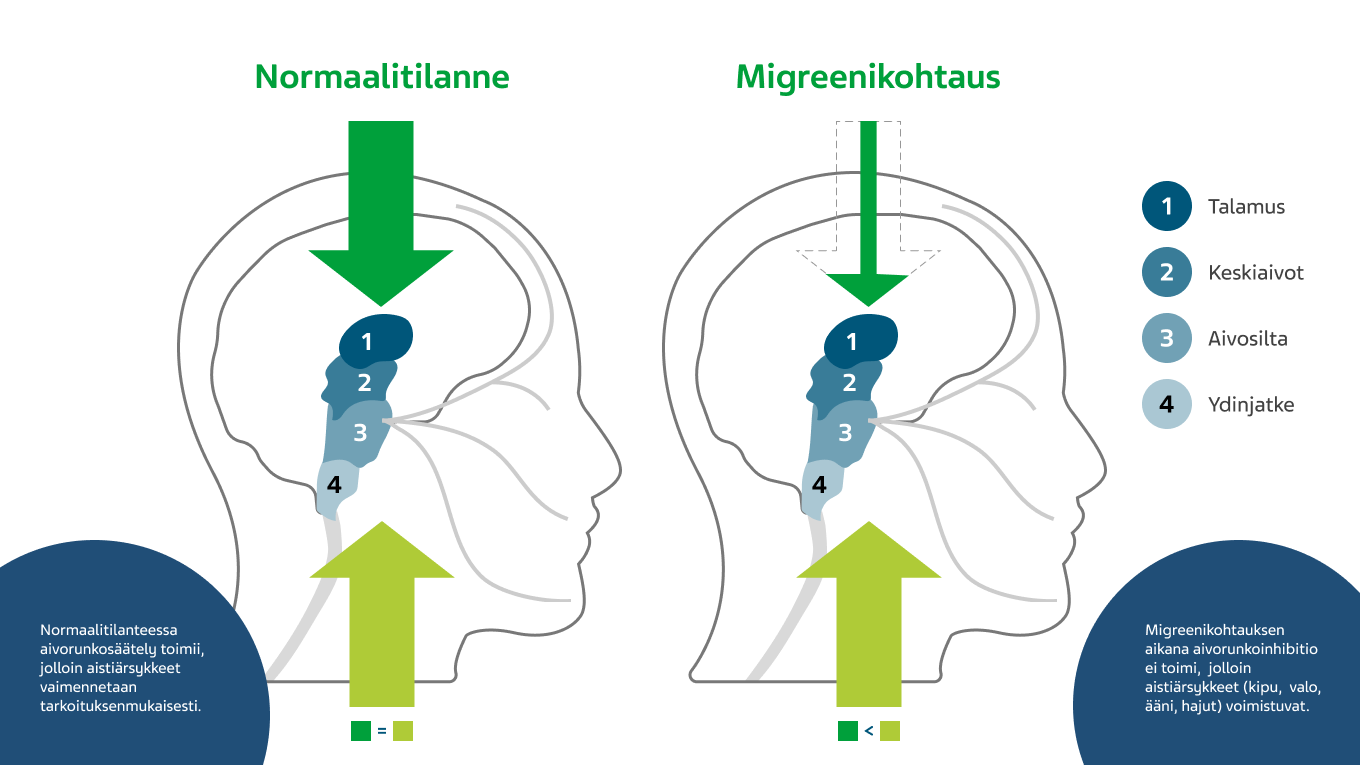
Kuva 5. Aivorungon tasapainotilanteen muutos migreenikohtauksen aikana.
Neurologiset auraoireet
Neurologisia auraoireita on joka kolmannella migreenipotilaalla ennen päänsärkyä. Migreeniauran uskotaan johtuvan aivokuoren (cortex) sisäsyntyisestä herkkyydestä, joka ilmenee taipumuksena Cortical Spreading Depression -ilmiöön (CSD). CSD on hermo- ja gliasolujen aktivaatiovaimentuma-aalto, joka etenee hitaasti pitkin aivokuorta. Sahanterämäinen värisevä ja laajeneva näköhäiriö onkin tyypillistä auralliselle migreenille. Oire kestää n. 20 – 30 minuuttia ja näkö palautuu täysin normaaliksi. Tämän jälkeen muutamien kymmenien minuuttien kuluttua alkaa kova, toispuoleinen ja sykkivä migreenipäänsärky. CSD-teoria sai alkunsa jo 1940-luvulla, kun Leao tutkimuksissaan ärsytti koe-eläinten aivokuorta ja sai aikaan hitaasti aivokuoren pintaa pitkin etenevän aktivaatioaallon, jota seurasi toiminnan vaimeneminen ja samanaikaisia verenkiertomuutoksia. Yhtäläisyydet CSD:n, migreenin ja migreeniauran välillä ovat ilmeiset, etenkin kun CSD-tyyppinen ilmiö voidaan kuvantaa ihmisen aivokuorella magneettikuvauksen (toiminnallinen fMRI) tai magnetoenkefalografian (MEG) avulla. 1,2
Video 1. Esimerkki auraoireesta merellä.
Migreenin mekanismit ja välittävät rakenteet tunnetaan siis jo suhteellisen hyvin. Staattinen neuroanatominen malli ei kuitenkaan selitä migreenin jatkuvasti muuttuvaa perusluonnetta – kohtausten voimakkuus, kesto, tiheys ja liitännäisoireet vaihtelevat potilaasta toiseen ja saman potilaankin kohdalla elämän eri vaiheissa. 1,2
Taulukko 1. Migreenin oireiden välittävät rakenteet ja mekanismit.
| Migreenille ominainen piirre tai oire | Välittävä rakenne tai mekanismi |
| Kohtauksellisuus | Ionikanavat, glutamaatti |
| Kipua inhiboivien järjestelmien pettäminen | |
| Prodromaalioireet (ennakko-oireet) | Hypotalamus |
| Aura | Aivokuori |
| Päänsäryn sykkivä luonne | Trigeminovaskulaarijärjestelmä |
| Kivun intensiteetti | Perifeerinen sensitaatio Parasympaattinen hermosto |
| Kivun pitkäkestoisuus | Sentraalinen sensitaatio |
| Liitännäisoireet | Trigeminoautonominen refleksi |
| Kroonistuminen | Sentraalinen sensitaatio |
| ”Migreenialttius” | Keskushermoston herkkyys monille erilaisille kohtauksia aiheuttaville tekijöille |
Migreeniverkko ja sen solmukohta
Migreenin vaihtelevaa kliinistä kuvaa selittää parhaiten aivomalli, jossa lukuisat eri rakenteet muodostavat toiminnallisen verkon. Verkon solmukohdat, kuten hypotalamus tai trigeminushermo, ovat erityisen tärkeitä verkon toiminnalle, mutta toisaalta koko verkon kulloinenkin tila määrää myös solmukohtien aktiivisuuden. Tämän takia migreeni on arvaamaton ja iskee näennäisen sattumanvaraisesti. Tiettynä ajankohtana provosoiva tekijä käynnistää kohtauksen, toisena päivänä ei. Migreeniverkko myös oppii ja muuttaa muotoaan iän kuluessa ja siksi taudin kliininen kuva vaihtelee elämän varrella. 1,2
Viime vuosina nimenomaan CGRP (Calcitonin Gene-Related Peptide) on osoittautunut keskeiseksi tekijäksi migreenikohtauksen aikana. Todennäköisesti monitekijäisen migreenin taustalla on kuitenkin lukuisia muita mekanismeja, joiden selvittäminen on tärkeää nimenomaan sille potilasryhmälle, joka ei saa riittävää apua CGRP-reitin patoamisesta. Tästä huolimatta CGRP-tarina on ollut 1990-luvun tripaaniaikakauden jälkeen merkittävin edistysaskel migreenitutkimuksessa. 1,2
- Goadsby PJ, Lipton RB. A review of paroxysmal hemicranias, SUNCT syndrome and other short-lasting headaches with autonomic feature, including new cases. 1997;120 ( Pt 1):193-209.
- Tfelt-Hansen PC, Koehler PJ. One hundred years of migraine research: major clinical and scientific observations from 1910 to 2010. Headache. 2011; 51: 752-78.
AJO-FI-00566-11-2024





